1. Quando Rutherford fez uma experiência bombardeando uma folha de ouro com partículas alfa, ele comprovou especialmente o erro no modelo de
a) Demócrito.
b) Thomson.
c) Bohr.
d) Dalton.
Muitas dessas teorias são aceitas até hoje, mas algumas já são ultrapassadas, vejamos porque:
- Os elementos químicos são formados por pequenas partículas denominadas átomos - Válido até hoje.
- Os átomos são partículas maciças e indivisíveis - Incorreto, pois o átomo é descontínuo e divisível.
- Os átomos de um mesmo elemento têm massas iguais e os átomos de elementos diferentes têm massas diferentes - Incorreto, devido à existência de isótopos, todos os átomos de um elemento não têm a mesma massa.
- Os átomos dos elementos permanecem inalterados nas reações químicas - Válido até hoje. Inclusive essa definição explica bem porque a massa é conservada nas reações químicas.
- Os compostos são formados pela ligação dos átomos dos elementos em proporções fixas - Correto. Essa é a Lei da composição definida, ela explica porque cada composto é caracterizado por proporções fixas. Cada átomo de um dado elemento presente em um composto tem a mesma massa, sendo assim, a composição deve ser sempre a mesma.
Em 1898, o físico inglês Joseph John Thomson, realizou experimentos científicos com descargas elétricas de gases e com a radioatividade, e sugeriu um modelo atômico. Segundo ele, como a tendência da matéria é ficar neutra, o número de cargas positivas teria que ser igual ao número de cargas negativas. As experiências realizadas no século XIX, juntamente com o átomo de Thomson, possibilitaram a descoberta do próton e do elétron. O modelo atômico de Thomson consiste em uma esfera carregada positivamente e que elétrons de carga negativa ficam incrustados nessa. Esse modelo foi apelidado de pudim de ameixas. Mais tarde, com novos experimentos, Thomson postulou que os elétrons estavam situados em anéis e esses se movimentam em órbitas ao redor da esfera positiva.
Para verificar se os átomos eram maciços, Rutherford bombardeou uma finíssima lamina de ouro (de aproximadamente 0,0001cm) com pequenas partículas de carga positivas, denominada partículas alfa, emitidas por um material radioativo.
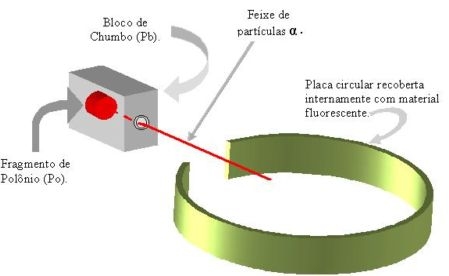
 As observações feitas durante o experimento levaram Rutherford a tirar uma serie de conclusões.
As observações feitas durante o experimento levaram Rutherford a tirar uma serie de conclusões.
A comparação do número de partículas alfa que atravessavam a lâmina com o número de partículas alfa que voltavam levou Rutherford a concluir que o raio do átomo é 10 mil vezes maior que o raio do núcleo. A partir dessas conclusões, Rutherford propôs um novo modelo atômico, semelhante ao sistema solar.
Resumidamente, na física atômica, o átomo de Bohr é um modelo que descreve o átomo como um núcleo pequeno e carregado positivamente cercado por elétrons em órbita circular.
2. Os átomos apresentam capacidade de ganhar ou perder elétrons, formando novos sistemas carregados eletricamente chamados íons. O íon X-2 apresenta 20 elétrons e 22 nêutrons, portanto, o elemento X tem
a) número atômico igual a 18.
b) número de massa igual a 42.
c) número de prótons igual a 20.
d) número de nêutrons igual a 20.
Observe as estruturas abaixo e responda a questão 3
3. Os números de oxidação dos elementos enxofre, fósforo, nitrogênio e carbono, nos ácidos
acima, são, respectivamente,
a) −6, +5, +6 e −4
b) +6, +5, +5 e +4
c) +6, +4, +6 e +4
d) −6, +4, +6 e −4
Ácido fosfórico (H3PO4), ficando +3+P-8=0, resolvendo S=+5.
Ácido nítrico (HNO3), ficando +1+N-6=0, assim N=+5.
Ácido carbônico (H2CO3), assim +2+C-6=0, sendo N=+4.
a) Demócrito.
b) Thomson.
c) Bohr.
d) Dalton.
Gabarito b
Comentários: de acordo com os modelos atômicos, Dalton acreditava que o átomo era uma esfera maciça, homogênea, indestrutível, indivisível e de carga elétrica neutra.Muitas dessas teorias são aceitas até hoje, mas algumas já são ultrapassadas, vejamos porque:
- Os elementos químicos são formados por pequenas partículas denominadas átomos - Válido até hoje.
- Os átomos são partículas maciças e indivisíveis - Incorreto, pois o átomo é descontínuo e divisível.
- Os átomos de um mesmo elemento têm massas iguais e os átomos de elementos diferentes têm massas diferentes - Incorreto, devido à existência de isótopos, todos os átomos de um elemento não têm a mesma massa.
- Os átomos dos elementos permanecem inalterados nas reações químicas - Válido até hoje. Inclusive essa definição explica bem porque a massa é conservada nas reações químicas.
- Os compostos são formados pela ligação dos átomos dos elementos em proporções fixas - Correto. Essa é a Lei da composição definida, ela explica porque cada composto é caracterizado por proporções fixas. Cada átomo de um dado elemento presente em um composto tem a mesma massa, sendo assim, a composição deve ser sempre a mesma.
Em 1898, o físico inglês Joseph John Thomson, realizou experimentos científicos com descargas elétricas de gases e com a radioatividade, e sugeriu um modelo atômico. Segundo ele, como a tendência da matéria é ficar neutra, o número de cargas positivas teria que ser igual ao número de cargas negativas. As experiências realizadas no século XIX, juntamente com o átomo de Thomson, possibilitaram a descoberta do próton e do elétron. O modelo atômico de Thomson consiste em uma esfera carregada positivamente e que elétrons de carga negativa ficam incrustados nessa. Esse modelo foi apelidado de pudim de ameixas. Mais tarde, com novos experimentos, Thomson postulou que os elétrons estavam situados em anéis e esses se movimentam em órbitas ao redor da esfera positiva.
Para verificar se os átomos eram maciços, Rutherford bombardeou uma finíssima lamina de ouro (de aproximadamente 0,0001cm) com pequenas partículas de carga positivas, denominada partículas alfa, emitidas por um material radioativo.

| Observações | Conclusões |
|---|---|
| Grande parte das partículas alfa atravessa a lâmina sem desviar o curso. | Boa parte do átomo é vazio. No espaço vazio (eletrosfera) provavelmente estão localizados os elétrons. |
| Poucas partículas alfa (1 em 20000) não atravessam a lâmina e voltavam. | Deve existir no átomo uma pequena região onde esta concentrada sua massa (o núcleo). |
| Algumas partículas alfa sofriam desvios de trajetória ao atravessar a lâmina. | O núcleo do átomo deve ser positivo, o que provoca uma repulsão nas partículas alfa (positivas). |
Resumidamente, na física atômica, o átomo de Bohr é um modelo que descreve o átomo como um núcleo pequeno e carregado positivamente cercado por elétrons em órbita circular.
2. Os átomos apresentam capacidade de ganhar ou perder elétrons, formando novos sistemas carregados eletricamente chamados íons. O íon X-2 apresenta 20 elétrons e 22 nêutrons, portanto, o elemento X tem
a) número atômico igual a 18.
b) número de massa igual a 42.
c) número de prótons igual a 20.
d) número de nêutrons igual a 20.
Gabarito: a
Comentários: o íon acima X-2 é um ânion, quer dizer que ele ganhou 2 elétrons e ficou com carga negativa. Assim, se ele apresenta 20 elétrons, signifca que ele tinha, quando neutro (X) 18 elétrons, portanto número atômico 18.Observe as estruturas abaixo e responda a questão 3
3. Os números de oxidação dos elementos enxofre, fósforo, nitrogênio e carbono, nos ácidos
acima, são, respectivamente,
a) −6, +5, +6 e −4
b) +6, +5, +5 e +4
c) +6, +4, +6 e +4
d) −6, +4, +6 e −4
Gabarito: b
Comentários: ácido sulfúrico (H2SO4), assim, fica +2+S-8=0, resolvendo a equação encontra-se S=+6.Ácido fosfórico (H3PO4), ficando +3+P-8=0, resolvendo S=+5.
Ácido nítrico (HNO3), ficando +1+N-6=0, assim N=+5.
Ácido carbônico (H2CO3), assim +2+C-6=0, sendo N=+4.


Nenhum comentário:
Postar um comentário